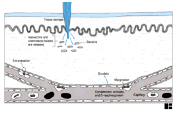
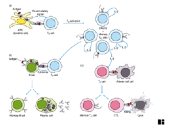
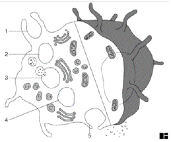
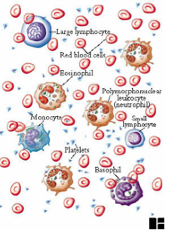
I.1.1 Chapter 1



I.1.2 Chapter 3: Cells & Organs
of the Immune System
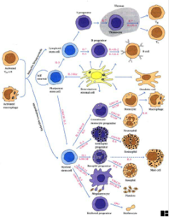
b_tmb.png)
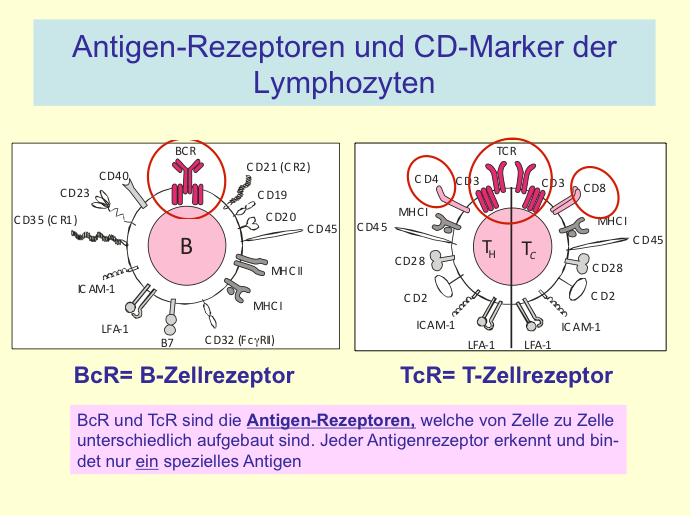
I.1.3 Chapter 3: B. Cluster of Differentiation (CD) Antigens (in cache)
I.1.4 Chapter 13: Cytokines
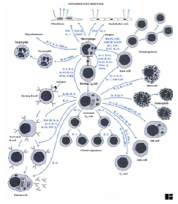
|
|

|
|
 |
 |
 |
 |
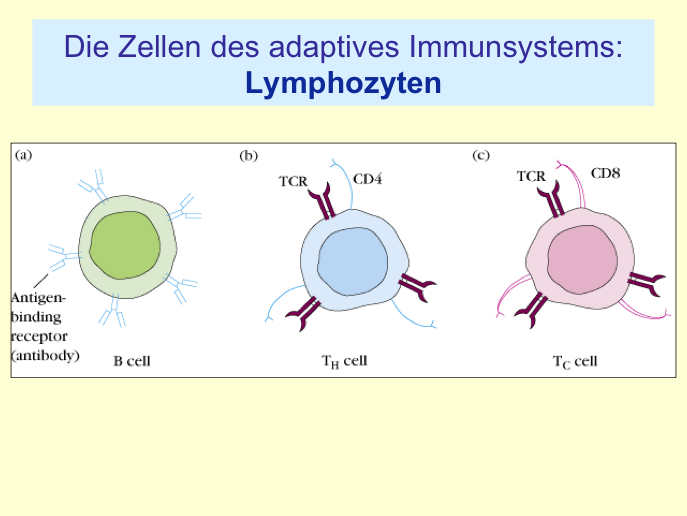
III.2 Immunology Refresher
III.3 Understanding JAK-Pathways
|

|
Sie wirken
Wu et al (1999) berichtet von einer verminderten Synthese des Lymphozyten-Wachstumshormons bei chronisch gestressten Pflegepersonen. Lymphozyten-Wachstumshormone reagieren auf Stress und beeinflussen von daher die Biologie der Zytokine (Beispiel: der Gesundheitsstatus von sozial gestressten Personengruppen ist unterdurchschnittlich.)
Endokrine Hormone und Zytokine finden sich gemeinsam in endokrinen Drüsen (Hypophyse und andere endokrine Gewebe enthalten Zytokine, z.B. Interleukine, die auto- oder endokrin wirken und die Sekretion von endokrinen Hormonen beeinflussen. Beispiel: IL-6 und TNF-alpha in den Nebennieren können an der lokalen Kontrolle der Synthese von Cortisol und anderen adrenalen Steroiden beteiligt sein.
Einige dieser Gewebezytokine können auch in den peripheren Blutkreislauf gelangen und wie Hormone funktionieren, indem sie in einiger Entfernung von der Ursprungszelle auf Zielgewebe einwirken. Beispiel: Leptin wirkt nicht nur auf die Nahrungsaufnahme, sondern auch auf die Einleitung der Menses und die Produktion von T-Lymphozyten-Zytokinen (Welt et al., 2004).
Wechselwirkung Hormone - Zytokine
Wirkung von akutem Stress auf die Zirkulation von Immunzellen ist abhängig vom Noradrenalin-
Die Konzentration proinflammatorischer Zytokine im Blut steigt -abhängig von der Cortisolreaktion- als Reaktion auf Stress (Kunz-Ebrecht et al. 2003)
Fahrradfahren oder Lösen einer Rechenaufgabe vor der impfung verbessert die Wirkung der Impfung (Edwards et al. 2006)
Wer auf akuten Stress stärker in seiner SAM- und HPA-Achse reagiert, wird bei Stress eher krank (Cohen and Hamrick 2003).
- angeborenes Immunsystem steht innerhalb von Stunden bereit ... wiederholte Exposition führt nicht zu einer gesteigerten Immunreaktion (kein memory) ...
- Das erworbene Immunsystem

Wikipedia: Somatic hypermutation, Targeting
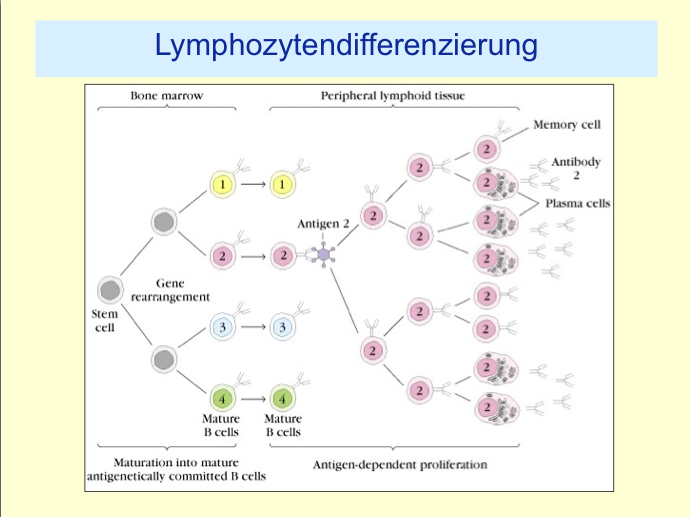
When a B cell recognizes an antigen, it is stimulated to divide (or proliferate). During proliferation, the B cell receptor locus undergoes an extremely high rate of somatic mutation that is at least 105-106 fold greater than the normal rate of mutation across the genome.[2] Variation is mainly in the form of single base substitutions, with insertions and deletions being less common. These mutations occur mostly at "hotspots" in the DNA, known as hypervariable regions. These regions correspond to the complementarity determining regions; the sites involved in antigen recognition on the immunoglobulin.[4] The exact nature of this targeting is poorly understood, although is thought to be controlled by a balance of error-prone and high fidelity repair.[5] This directed hypermutation allows for the selection of B cells that express immunoglobulin receptors possessing an enhanced ability to recognize and bind a specific foreign antigen.[1]
The hypermutation process also utilizes cells that auto-select against the 'signature' of an organism's own cells. It is hypothesized that failures of this auto-selection process may also lead to the development of an auto-immune response.
- The introduction of mutations in the rapidly-proliferating population of B cells ultimately culminates in the production of thousands of B cells, possessing slightly different receptors and varying specificity for the antigen, from which the B cell with highest affinities for the antigen can be selected.
- The B cells with the greatest affinity will then be selected to differentiate into plasma cells producing antibody and long-lived memory B cells contributing to enhanced immune responses upon reinfection.[2]
- hat beim Kontakt mit einem unbekanntem Antigen eine Latenz von ca. 5 Tagen, bis die Immunantwort eine klinische Relevanz erreicht. ...
- ist spezifisch ...
- steigert Spezifität noch im weiteren Verlauf ...
- immunologisches Gedächtnis ...
- seine Aktivierung unterliegt einer komplexen Regulierung, die eine vorschnelle oder unangemessene Immunreaktion verhindert. Seine Zellen treten erst nach einem Aktivierungsschritt (durch Antigen-präsentierenden Zellen, wenn diese in ihrem MHC-II ein Peptide präsentieren) in Aktion.
"T-Lymphozyten werden im Knochenmark gebildet und reifen dann im Thymus zu den entsprechenden Subpopulationen heran (von Thymus stammt der Name T-Lymphozyten). Der T-Zell-Rezeptor wird, ähnlich wie der B-Zell-Rezeptor, durch somatische Rekombination auf das Vielfältigste gestaltet. Im Thymus wird im Rahmen der Reifung der T-Lymphozyten geprüft, ob der T-Zell-RezeptorIst der Rezeptor nicht bindungsfähig oder erkennt er körpereigene Strkturen, wird er apoptotisch untergehen.
- einerseits bindungsfähig ist,
- andererseits, ob er körpereigene Strukturen erkennt.
Es wird davon ausgegangen, dass nur etwa 5% der T-Lymphozyten die Thymussselektion überstehen.
Die Unterdrückung von selbstreaktiven T-Lymphozyten ist ein wichtiger Schritt zur Vermeidung von Autoimmunreaktionen."
(zitierte Stelle in Schubert, Psychoneuroimmunologie und Psychotherapie).